Wielu pacjentów cierpi z powodu nawracających chorób infekcyjnych. Do niedawna medycyna nie znała odpowiedzi na pytanie, dlaczego tak się dzieje – jednak ostatnie lata przyniosły przełom w myśleniu o mikroorganizmach.
Myśląc o bakteriach, najczęściej wyobrażamy je sobie jako pojedyncze komórki, czyli formy planktonowe, łatwo wykrywalne przez układ odpornościowy.
Większość bakterii chorobotwórczych w organizmie formuje jednak osiadłe społeczności zwanych biofilmami, utrudniające ich eradykację. Biofilmy można opisać jako stworzone przez bakterie twierdze, pokryte śluzem, w którym uwięzione są jony metali. Rosną w środowisku wodnym i zazwyczaj przylegają ściśle do powierzchni. Biofilmy bakteryjne i grzybicze są przyczyną nawrotów u pacjentów cierpiących na trudne do wyleczenia infekcje. Według NIH (National Health Institute, USA) ponad 80% ludzkich zakażeń bakteryjnych jest związanych z biofilmem. Tworzenie biofilmu to formowanie kolonii, w której komórki bakteryjne są mniej podatne na środki przeciwdrobnoustrojowe i niszczenie przez mechanizmy efektorowe układu odpornościowego gospodarza. Aby utworzyć biofilm, bakterie najpierw przywierają do powierzchni, a następnie wytwarzają matrycę polisacharydową,która jak gąbka gromadzi wapń, magnez, żelazo, a także metale ciężkie i inne minerały. Taka struktura umożliwia patogenom przetrwanie w nieprzyjaznych warunkach środowiska, a także kolonizację nowych nisz.
W medycynie od niedawna funkcjonuje pojęcie choroby związanej z biofilmem. Początkowo rozpoznawano ją głównie w chirurgii, gdzie wykrywano je na implantach, jednak ten problem dotyczy wszelkich dziedzin medycyny. Biofilm zapewnia mikroorganizmom wysoką tolerancję na konwencjonalne środki przeciwbakteryjne i bierze udział w wywoływaniu nawrotów zakażeń . W strukturach biofilmu jeden lub więcej rodzajów bakterii czy grzybów dzieli się składnikami odżywczymi i wymienia DNA, ulegając nieustannym zmianom, by ukryć się przed naszym układem odpornościowym.
Zasadniczą cechą biofilmów jest tworzenie pozakomórkowej matrycy polisacharydowej, która pomaga zapewnić ochronę przed antybiotykami i enzymami oraz wspiera wytwarzanie mikrośrodowiska dla metabolicznej interakcji populacji. Biofilm wymaga mniej tlenu i mniej składników odżywczych, ma także inne pH zewnętrzne i inne wewnętrzne, dlatego skutecznie przeciwdziała penetracji antybiotyków.Ponadto biofilmu tworzy fizyczną barierę, która powstrzymuje większość komórek odpornościowych przed wykryciem patogennych bakterii.
Leczenie chorób związanych z biofilmami za pomocą antybiotyków jest trudne. Na przykład u pacjentów cierpiących na choroby zapalne jelit początkowo antybiotyki zaczynają działać, po czym następuje efekt nawrotu, gdy objawy ponownie się nasilają, na skutek narastającej antybiotykooporności mającej źródło w biofilmie. Przewód pokarmowy jest idealnym środowiskiem dla bakterii,grzybów i powiązanych biofilmów ze względu na jego dużą powierzchnię i stały dopływ składników odżywczych. Nabłonek jelita jest wyścielony lepkim, sprężystym śluzem, pełniącym funkcję ochronną. Zaburzenia produkcji tego śluzu, współistniejące z mikrouszkodzeniami i stanem zapalnym, sprzyjają przyleganiu biofilmu w miejscu uszkodzenia. Dzieje się tak m.in. u osób z SIBO, z zapalnymi chorobami jelit (IBD), a także z chorobami autoimmunologicznymi, takimi jak choroba Leśniowskiego-Crohna.
Podobne mechanizmy towarzyszą nawracającym zapaleniom ucha, zapaleniom zatok czy przewlekłej obturacyjnej chorobie płuc. Mikrouszkodzenia błon śluzowych, nieprawidłowe struktury nabłonka, takie jak polipy, ułatwiają przyczepianie (adhezję) bakterii do powierzchni i rozpoczęcia budowy biofilmu, poprzez mocowanie go do zmienionych chorobowo miejsc.
Biofilmy są trudne do zdiagnozowania, gdyż tworzące je bakterie ukryte są w matrycy. Dlatego wymazy i posiewy często okazują się negatywne. Mimo ujemnych wyników hodowli mikroorganizmy formujące biofilm mogą oddziaływać toksycznie na organizm. Niektóre techniki laboratoryjne, w szczególności analiza kwasów organicznych, jak badanie ONE i Organix, mogą pośrednio wskazywać na obecność w organizmie biofilmu, poprzez wykrywanie charakterystycznych toksyn grzybiczych i bakteryjnych. Badania te wykrywają także niedobory mineralne i witaminowe oraz kontrolują zaburzenia szlaków detoksyfikacji, które często są problemem u osób dotkniętych chorobą biofilmu. Bakterie konkurują z organizmem gospodarza o środki odżywcze, takie jak związki mineralne i witaminy, prowadząc do znaczących niedoborów.
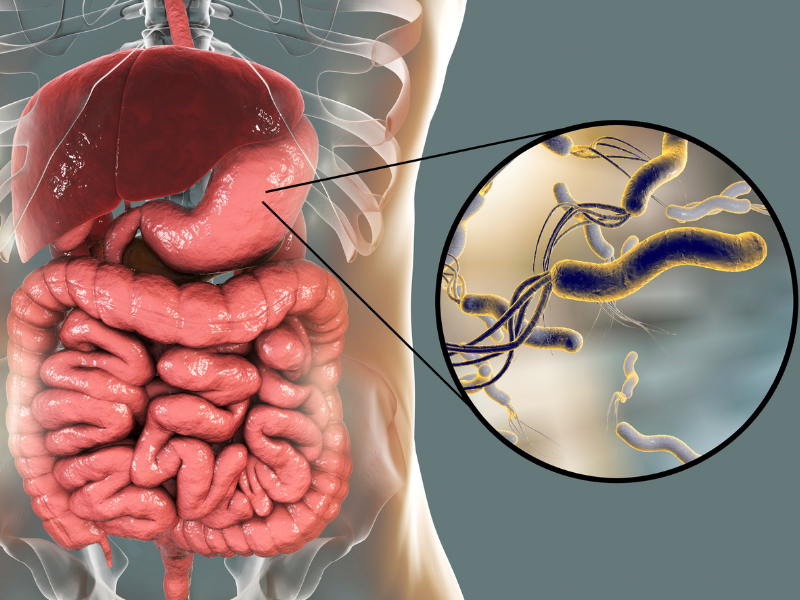
Nauka ostatnio odkryła rolę biofilmu w chorobach reumatycznych, krążenia i autoimmunologicznych. Szczególnie biofilm w jamie ustnej zwrócił ostatnio uwagę badaczy, gdyż ma udział w schorzeniach neurologicznych, takich jak choroba Alzheimera, i zaburzeniach ze spektrum autyzmu (ASD). W obydwu tych jednostkach chorobowych wykryto zmieniony biofilmu w jamie ustnej.
W chorobie Alzheimera czynnikiem patogennym jest bakteria Porphyromonas gingivalis, produkująca toksyczne gingipainy. Bakteria ta powoduje choroby dziąseł i przyzębia, wiąże się także z zapaleniem stawów i miażdżycą. W badaniach nad dziećmi z autyzmem stwierdzono, że zarówno ich mikroflora jelitowa, jak i mikroflora jamy ustnej, różnią się znacząco od mikroflory dzieci zdrowych. Wczesne interwencje, takie jak suplementacja Lactobacillus rhamnosus w niemowlęctwie, wykazały znaczącą redukcję występowania chorób ASD u dzieci, które otrzymywały ten szczep probiotyczny. Co ciekawe, bakteria ta sama ma zdolności formowania biofilmu, dzięki zdolności adherencji do śluzówki przewodu pokarmowego, blokując wzrost toksynogennej Escherichia coli i bakterii z rodzaju Salmonella.
Zdolność Lactobacillus rhamnosus do formowania biofilmu jest wyjątkowa, zachodzi ona nawet przy braku glukozy w podłożu. Lactobacillus rhamnosus ma zdolność zmiany biofilmu w jamie ustnej, tym samym indukując zmiany mikrobiomu całego przewodu pokarmowego bez zwiększania fermentacji w jelicie. Forma podjęzykowa tego probiotyku najlepiej spełnia swoje zadanie. Oś ustno-jelitowa, poprzez oddziaływanie mikrobiotów, ma wpływ na funkcje immunologiczne całego organizmu. Obecnie jednym z najlepszych sposobów zwalczających biofilm jest zastosowanie interferencji bakteryjnej. Głównym założeniem jest wykorzystanie szczepu niepatogennego do wytworzenia biofilmu w organizmie pacjenta. Szczep Lactobacillus rhamnosus jest w tym kontekście najbardziej obiecujący poprzez unikalne właściwości tworzenia biofilmu probiotycznego.
Najlepiej działa on przy dodatku ksylitolu, który w badaniach nad próchnicą przewyższa skutecznością płukanki z chlorheksydyny, popularnego środka odkażającego. Dodatek ksylitolu do gum do żucia pomaga zwalczyć biofilmy w zatokach. Należy jednak pamiętać, że ksylitol w większych ilościach może nasilać fermentację jelitową, prowadząc do pogorszenia dolegliwości związanych z SIBO czy chorobami zapalnymi jelit. Ważnym elementem walki z biofilmem są enzymy trawiące polisacharydową macierz, ułatwiające przedostanie się komórek fagocytarnych i środków bakteriobójczych do jego wnętrza.
Tradycyjnie najlepiej poznane w tym wskazaniu są świeże wyciągi z papai, w medycynie ajurwedyjskiej stosowane do leczenia trudno gojących, zakażonych ran. Obecnie wyciąg z papai (Caricol) badany jest na wielu uniwersytetach, wykazuje działanie modyfikujące biofilm w przewodzie pokarmowym. Wyciągi z Carica papaya wykazały działanie w opornych infekcjach wywołanych rzez Streptococcus pyogenes, poprzez rozbijanie tworzonego przez tę bakterię biofilmu.

Biofilm bakteryjny a stewia
Źródła:
Hernández-Jiménez E., del Campo R., Toledano V., Vallejo-Cremades M.T.,Muñoz A., Largo C. et al. Biofilm vs. planktonic bacterial mode of growth: Which do human macrophages prefer? Biochem Biophys Res Commun[Internet]. 2013 Nov 29 [cited 2019 Apr 1]; 441(4): 947-52. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24239884.
Baune B.T., editor. Oxidative stress in autism. J Autism Dev Disord[Internet]. A.W.Zimmer. 2010 Jan 1 [cited 2012 Mar 3];9(3):1-8. Available from: http://onlinelibrary.wiley.com/doi/10.1002/cbdv.200490137/abstract.
Römling U., Balsalobre C. Biofilm infections, their resilience to therapy and innovative treatment strategies. J Intern Med [Internet]. 2012 Dec [cited 2019 Apr 1]; 272(6): 541-61. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23025745.
Schorer M., Eisele M. Accumulation of inorganic and organic pollutantsmm by biofilms in the aquatic environment. Water, Air, Soil Pollut [Internet].1997 Oct [cited 2019 Apr 1]; 99(1-4): 651-9. Available from: http://link.springer.com/10.1007/BF02406904.
Del Pozo J.L. Biofilm-related disease. Expert Rev Anti Infect Ther[Internet]. 2018 Jan 2 [cited 2019 Apr 1]; 16(1): 51-65. Available from:http://www.ncbi.nlm.nih.gov/pubmed/29235402.
Barshak M.B., Durand M.L. The role of infection and antibiotics in chronicrhinosinusitis. Laryngoscope Investig Otolaryngol [Internet]. 2017 Feb[cited 2019 Apr 1]; 2(1): 36-42. Available from: http://www.ncbi.nlm.nih.gov/pubmed/28894821.
Xiao J., Hara A.T., Kim D., Zero D.T., Koo H., Hwang G. Biofilm threedimensional architecture influences in situ pH distribution pattern on the human enamel surface. Int J Oral Sci [Internet]. 2017 Jun 28 [cited 2019 Apr 1];9(2): 74-9. Available from: http://www.nature.com/doifinder/10.1038/ijos.2017.8.
Maciejewska M., Bauer M., Dawgul M. Nowoczesne metody zwalczania biofilmu bakteryjnego. Postep Mikrobiol. 2016; 55(1): 3-11.
Chassaing B., Darfeuille-Michaud A. The σE pathway is involved in biofilm formation by Crohn’s disease-associated adherent-invasive Escherichia coli. J Bacteriol [Internet]. 2013 Jan [cited 2019 Apr 15]; 195(1): 76-84. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23104802.
Burmølle M., Thomsen T.R., Fazli M., Dige I., Christensen L., Homøe P. et al. Biofilms in chronic infections – a matter of opportunity – monospecies biofilms in multispecies infections. FEMS Immunol Med Microbiol [Internet]. 2010 Aug [cited 2019 Apr 1]; 59(3): 324-36. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20602635.
von Rosenvinge E.C., O’May G.A., Macfarlane S., Macfarlane G.T.,Shirtliff M.E. Microbial biofilms and gastrointestinal diseases. Pathog Dis [Internet]. 2013 Feb [cited 2019 Apr 1]; 67(1): 25-38. Available from:http://www.ncbi.nlm.nih.gov/pubmed/23620117.


WYSYŁKA BADAŃ
Najbliższe terminy wysyłek do Stanów (badania Metabolomix, Gi effects, CSA, CSAP2, Clostridium, Mikrobiologia, Uroporfiryny,
Badanie włosa, P. Cunningham, OAT)
kwiecień: 23.04.2024
maj: 14.05.2024, 28.05.2024
czerwiec: 11.06.2024, 25.06.2024
Próbki do badań wykonywanych w USA (mocz, kał, włosy, ślina) należy dostarczyć osobiście lub wysłać kurierem dzień wcześniej (zawsze są to poniedziałki), tak aby w terminie wysyłki dotarły do Arcany (zawsze we wtorki). Próbki do badań należy pobierać w weekend przed wysyłką, zgodnie z dołączonymi do zestawów instrukcjami.
Próbki surowicy do badań w CM Wielkoszyński można dostarczyć do Arcana w każdy poniedziałek (z wyjątkiem 01 oraz 29.04.2024) w godzinach otwarcia lub wtorek do godziny 15:00 z wyjątkiem tygodni, w które wypadają dni świąteczne lub instytut jest zamknięty.